W jaki sposób technologia wykrywania tlenu może zapewnić szybsze wyniki testów mikrobiologii żywności i napojów
„How Oxygen Sensing Technology Can Deliver Faster Test Results for Food and Beverage Microbiology”
Article by Colin Fricker, Dilidaer Yusufu and Andrew Mills
Oculer Ltd, Ballina, Ireland and School of Chemistry and Chemical Engineering, Queens University, Belfast, UK
Dlaczego warto skorzystać z czujnika O2?
Czujniki O2 są szeroko stosowane w wielu dziedzinach biologii i zostały zastosowane do monitorowania aktywności i wzrostu bakterii w środowisku. Połączenie odpowiednich pożywek, temperatury i unieruchomionego czujnika detekcji O2 może konsekwentnie i dokładnie wykrywać wzrost mikroorganizmów, w tym bakterii, drożdży i grzybów. Gdy organizmy rosną, wyczerpują tlen w pożywce i w pewnym momencie to wyczerpanie wpływa na czujnik, powodując bardzo szybki wzrost aktywności barwnika, który może być wykryty przez odpowiedni instrument.
Używanie odpowiedniego czujnika O2 w połączeniu z odpowiednim polimerem stabilizującym skutkuje uzyskaniem systemu detekcji, który ma długi okres trwałości i jest odporny na ciepło, pH lub siły jonowe pożywek. Ponieważ polimer używany do unieruchomienia czujnika jest nieprzepuszczalny dla większości cząsteczek innych niż gazy, na czujnik nie mają wpływu różne matryce żywności ani ładunki jonowe. Brak wpływu pH oznacza, że media mogą być buforowane do pH >7,0 aby umożliwić szybszy wzrost i regenerację niektórych organizmów. Nie jest to pożądane przy metodach mierzących poziom dwutlenku węgla, ponieważ w takich warunkach pH CO2 jest początkowo przekształcany w wodorowęglan, co powoduje dłuższe czasy wykrywania.
Teoria stojąca za czujnikami O2
Prawie wszystkie komercyjne optyczne czujniki O2 opierają się na zdolności O2 do tłumienia luminescencji emitowanej przez barwnik, D. Gama barwników wykorzystywanych do tego celu jest ograniczona i większość zawiera platynę lub ruten. D (barwnik) będzie „świecić”, gdy jest wystawiony na działanie światła, które pochłania; światło wzbudzenia. Długości fal, tj. kolory wzbudzenia i wynikająca z nich luminescencja są zwykle bardzo różne, co ułatwia monitoring. Jeśli światło wzbudzenia jest dostarczane jako stały strumień do barwnika, będzie on świecić w sposób ciągły.
Jednakże, w przypadku czujników O2 jest on dostarczany w postaci bardzo krótkiego impulsu, tj. błysku, natężenie luminescencji natychmiast osiągnie szczyt, a następnie rozpadnie się do zera. W praktyce czas potrzebny na zakończenie tego rozpadu jest trudny do określenia, a więc zamiast tego mierzy się czas, w jakim szczytowe natężenie luminescencji zmniejsza się o określony ułamek. W fotochemii w ogóle i O2 w szczególności ta frakcja jest zawsze odwrotnością liczby naturalnej, e, (2,71828), a więc ułamek wynosi 0,368. Czas jest określany jako żywotność luminescencji, Τ, barwnika.
Dla wszystkich barwników luminescencyjnych wartość Τ w przypadku braku O2, tj. Τo, jest charakterystyczna dla barwnika, a więc jest inna dla każdego barwnika. Dla O2-wrażliwych barwników, Τo wynosi zazwyczaj 40-100 ms, a Τ zmniejsza się wraz ze wzrostem ciśnienia cząsteczkowego O2, PO2, zgodnie z równaniem Sterna-Volmera,
Τo/Τ = 1 + KSVPO2
gdzie KSV jest stałą Sterna-Volmera, która zależy zarówno od Τo i tempa, w którym O2 przesuwa się do barwnika i gasi jego luminescencję.
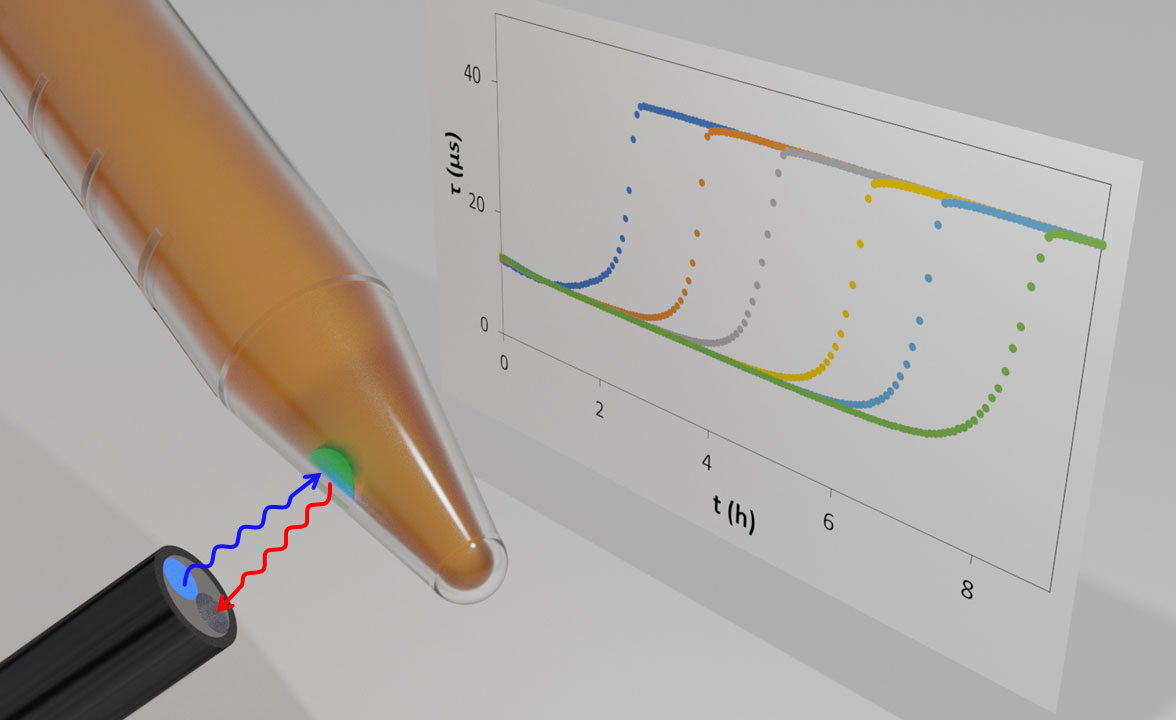
W większości komercyjnych wskaźników optycznych O2, barwnik luminescencyjny jest osadzony w O2-przepuszczalnym tworzywie sztucznym, tworząc kolorową „kropkę” – często zieloną ze względu na barwnik porfiryny Pt zwykle stosowany do tych celów. „Kropka” czujnika jest zwykle osadzana na ścianie przezroczystej butelki lub probówki, która zawiera badane medium, wodne lub gazowe. Żywotność barwnika w kropce jest następnie monitorowana za pomocą sondy czujnika dociskanej do probówki, naprzeciwko „kropki” jak pokazano na rysunku 1. Sonda czujnika dostarcza światło wzbudzenia, zbiera światło luminescencji i mierzy jego żywotność.
Przy zastosowaniu w mikrobiologii do oznaczania log (jtk) w badanej próbce, pożywka wzrostowa jest umieszczana w fiolce i inokulowana badaną próbką. Gdy bakterie rosną w podłożu, poziom rozpuszczonego O2 zmniejszy się z wartości początkowej związanej z nasyceniem roztworu powietrzem , tj. 0,21 atm, do zera, a więc zmierzona wartość Τ wzrośnie z jej wartości w roztworze nasyconym powietrzem do Τo. Typowy zestaw profili czasu Τ vs inkubacji dla zakresu różnych wartości inokulacji cfu zilustrowano na rysunku 1. Profile te można wykorzystać do stworzenia prostego wykresu kalibracyjnego odnoszącego logarytm (cfu) do czasu poświęconego na osiągnięcie ustalonej wartości Τ, tj. określonego poziomu O2. Ten wykres kalibracji można następnie wykorzystać do określenia wartości logarytmu (jtk) w próbce testowej dla bakterii.
Rysunek 1
Prostota badań
Zastosowanie systemów umożliwiających bezpośrednie wykrywanie zmian w pożywkach kulturowych spowodowanych wzrostem drobnoustrojów pozwala na niezwykle prostą detekcję w znacznie krótszym czasie. W ten sposób zazwyczaj czujnik jest unieruchomiony w probówce do hodowli i dodawana jest pożywka. Badana próbka jest następnie dodawana bezpośrednio do probówki i inkubowana w połączonym inkubatorze/czytniku na czas trwania badania. Czujnik jest skanowany w częstych odstępach czasu i gdy wykryje znaczący spadek O2 uzyskuje się zmianę w odczycie, ostrzegając użytkownika, że próbka zawiera interesujące mikroorganizmy. Ponieważ nie ma potrzeby czekać na utworzenie się kolonii, zgodnie z wymogami tradycyjnych metod stosowanych do określania obciążenia mikrobiologicznego, wyniki są dostępne szybko, a im wyższe obciążenie mikrobiologiczne, tym szybciej uzyskuje się sygnał dodatni.
System greenlight™ Oculer Ltd. jest samodzielnym instrumentem stacjonarnym zawierającym inkubator i detektor luminescencji, którego zastosowanie nie wymaga specjalistycznej wiedzy mikrobiologicznej. Fiolki na próbki zawierające odpowiednie pożywki są dostarczane po napromieniowaniu gamma. Istnieją dwie wersje przyrządu odpowiednie do inkubacji fiolek o wymiarach 48 x 2 ml lub fiolek 24 x 15 ml. Jeśli próbki są inkubowane w trybie offline, całkowita liczba próbek, które można uruchomić, wzrasta odpowiednio do 432 i 216. W trybie ilościowym instrument Greenlight oblicza stężenie bakterii docelowych, a wyniki są wyrażane jako jednostki tworzące kolonie.

System Greenlight został zastosowany do szerokiej gamy matryc, w tym napojów mlecznych i niemlecznych, napojów gazowanych, jogurtu, wody procesowej, soku owocowego i mnóstwa innych płynnych i półstałych matryc. Dostępne są badania całkowitej liczby drobnoustrojów, drożdży i pleśni, colifirms, E.coli, Alicyclobacillus spp. i sterylności handlowej. Dostępny jest również zestaw do monitorowania czystości powierzchni. Wielkość użytej próbki może wynosić do 10 ml w zależności od próby. Większość tych oznaczeń kończy się w ciągu 24 godzin, czas na badanie drożdży i pleśni skraca się z 5-7 dni do 48 godzin, a dla Alicyclobacillus czas trwania analizy wynosi maksymalnie 72 godziny.
Zastosowanie Greenlight™ do komercyjnych testów sterylności
System Greenlight idealnie nadaje się do określania sterylności komercyjnej. Zastosowanie dużej wielkości próbki (10 ml) wraz z niewielką ilością skoncentrowanej pożywki pozwala na wykrycie wzrostu tylko tych organizmów, które mogą rosnąć w rzeczywistym produkcie. Zastosowanie minimalnego rozcieńczenia zapewnia, że pH i stężenie naturalnie występujących inhibitorów drobnoustrojów jest zbliżone do występujących w oryginalnym produkcie, zapobiegając w sposób naturalny wzrostowi organizmów, które nie są przedmiotem badań, ponieważ nie byłyby zdolne do wzrostu w gotowym produkcie. To znacznie zwiększa wiarygodność testu.
Niedawne badanie z wykorzystaniem mleka smakowego pochodzenia roślinnego i innych napojów bezalkoholowych (496 próbek) wykazało, że Greenlight był bardziej wrażliwy i szybszy w porównaniu ze standardowymi metodami płytkowymi. Próbki gotowego produktu inokulowano małą liczbą potencjalnych zanieczyszczeń (1-10 jtk/100 ml) i inkubowano przez siedem dni. Dodatkowe próbki przygotowano przez rozcieńczenie do wyginięcia, przed inkubacją przez siedem dni. Po inkubacji próbki zostały przeanalizowane równolegle przez posiew płytkowy wgłębny, powierzchniowy oraz Greenlight.
Tabela 1: Porównanie posiewu płytkowego Greenlight, wgłębnego (1,0 ml) oraz powierzchniowego (0,1 ml) do wykrywania próbek dodatnich w 496 komercyjnych testach sterylności.
Greenlight wykrył wzrost w większej liczbie próbek niż tradycyjna technika wylewania płytek i dał wyniki w ciągu 48 godzin (w rzeczywistości najdłuższy okres inkubacji w celu zarejestrowania pozytywnego wyniku wynosił 29 godzin i 11 minut). Nic dziwnego, że płytki wylewowe wykryły więcej pozytywnych próbek niż płytki powierzchniowe. System Greenlight został użyty do zbadania 10 ml próbki, posiew wgłębny do 1 ml a powierzchniowy do 0,1 ml. Oczywiste jest, że w wielu przypadkach, nawet po siedmiu dniach inkubacji, liczba obecnych organizmów jest stosunkowo niska, o czym świadczą różnice w wykrywaniu przy użyciu różnych objętości próbek.
Zastosowanie dużej (10 ml) próbki zwiększa czułość i znacznie skraca całkowity czas wykrywania zanieczyszczeń. Inne metody wykrywania wzrostu po początkowej inkubacji, które wykorzystują jeszcze mniejsze rozmiary próbek, takie jak ATP, zapewniając jednocześnie szybki wynik, pominą znaczną liczbę pozytywnych próbek, które zostałyby wykryte przez Greenlight. Zastosowanie systemu Greenlight™ oferuje znaczne korzyści w zakresie komercyjnych testów sterylności, zarówno pod względem szybkości, jak i czułości.
O autorach
 |
Colin Fricker jest głównym naukowcem w firmie Oculer Ltd zajmującym się opracowywaniem szybkich testów do wykrywania skażenia mikrobiologicznego w żywności, wodzie, produktach higieny osobistej czy farmaceutyki. Jest członkiem Królewskiego Towarzystwa Biologicznego (Royal Society of Biology) i Królewskiego Towarzystwa Zdrowia Publicznego (Royal Society for Public Health). Jest aktywnym członkiem kilku komitetów ISO, a także członkiem Grupy Roboczej IFU Microbiology. Colin jest autorem wielu publikacji na temat różnych aspektów mikrobiologii, od środowiskowej po kliniczną. | |
 |
Dr Dilidaer Yusufu uzyskała tytuł licencjata na Beijing Institute of Technology (Chiny) w 2013 roku, a stopień doktora na Queen’s University Belfast w 2019 roku. Obecnie pracuje jako badacz podoktorski w grupie prof. Andrew Millsa na Queen’s University Belfast . Jej zainteresowania badawcze skupiają się głównie na rozwoju czujników kolorymetrycznych i fluorescencyjnych O2 i CO2 ze szczególnym uwzględnieniem ich zastosowania w opakowaniach żywności i monitorowaniu ran. | |
 |
Andrew Mills jest profesorem chemii materiałowej w School of Chemistry and Chemical Engineering na Queen’s University w Belfaście. Jego zainteresowania badawcze obejmują: fotochemię barwników i półprzewodników, katalizę redoks, konwersję energii słonecznej oraz wskaźniki oparte na kolorach i fluorescencji. Jest laureatem nagrody RSC Materials for Industry – Derek Birchall Award 2019 za pionierską pracę nad inteligentnymi czujnikami optycznymi – atramentami, pigmentami i wytłaczanymi technologiami tworzyw sztucznych. |
Powyższy wpis stanowi tłumaczenie artykułu dostępnego na stronie: www.rapidmicrobiology.com
 Newsletter
NewsletterWspóładministratorem danych jest firma Bentley Polska Sp. z o.o. Twój adres e-mail będzie wykorzystywany jedynie do rozsyłania informacji marketingowych. Zawsze możesz zrezygnować z otrzymywania naszych wiadomości. Więcej informacji można uzyskać pisząc na adres e-mail: iod@bentley.pol.pl